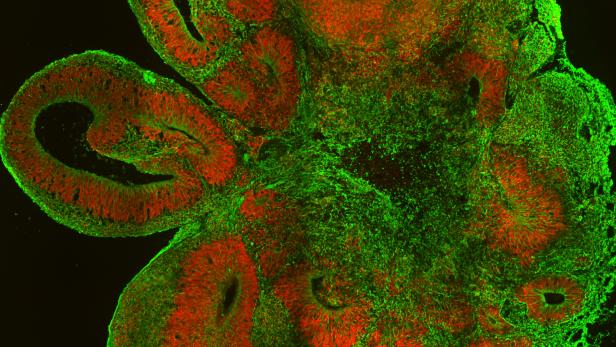
Ein Querschnitt durch ein Gehirn-Organoid : Neuronale Stammzellen in grün und Neuronen in rot
Der Traum vom Gehirn aus dem Glas
Dieser Artikel ist älter als ein Jahr!
Vor fünf Jahren hat das Institut für Molekulare Biotechnologie (IMBA) der Österreichischen Akademie der Wissenschaften (ÖAW) in Wien international Schlagzeilen gemacht. Die Entwicklung sogenannter zerebraler Organoide aus menschlichen Stammzellen wurde von der renommierten Fachzeitschrift Science unter die zehn wichtigsten wissenschaftlichen Entdeckungen des Jahres 2013 gewählt. In der Presse wurden die Organoide als gezüchtete „Mini-Gehirne“ bezeichnet. Fünf Jahre später wird am IMBA immer noch Spitzenforschung mit Stammzellen gemacht. Die maximal drei Millimeter großen Stücke aus Gehirngewebe, die in Kulturbehältern gezüchtet werden, sind immer noch ein wichtiger Teil der Arbeit am Institut.

Jürgen Knoblich
© IMBA
Mehr Struktur
Seit 2013 sind die Organoide deutlich komplexer geworden. Waren die ursprünglichen Gewebeklumpen noch homogen, was ihren zellulären Aufbau angeht, können die Forscher mittlerweile Zellkulturen aus verschiedenen Hirnarealen zusammenkleben. „Im Großhirn gibt es grob gesprochen zwei Arten von Nervenzellen, erregende und dämpfende. Sie entstehen in verschiedenen Teilen des Gehirns. Wir haben beide Areale in Organoiden modelliert und zusammengeklebt. Die frühen Organoide fusionieren miteinander und es bilden sich Strukturen. Die Zellen wandern von selbst an die richtigen Stellen. Wir staunen immer wieder, was alles ohne Zutun funktioniert“, erklärt IMBA-Direktor Jürgen Knoblich im Gespräch mit der futurezone.
Bei Organoidmodelle mit nur aktivierenden Nervenzellen kommt es zu einer chaotischen Aktivierung der Zellen. Ähnliches passiert im menschlichen Gehirn bei einem epileptischen Anfall. Organoide mit aktivierenden und hemmenden Nervenzellen zeigen diese Auffälligkeit nicht. Hier liegt auch das große Potenzial der zerebralen Organoide: Am IMBA werden sie eingesetzt, um Krankheiten am Modell besser zu verstehen. Im Fall der Epilepsie steht etwa die Wanderung der verschiedenen Zelltypen an ihren vorgesehenen Ort im Gehirn in Verdacht, eine mögliche Ursache für die Krankheit zu sein. Das können Forscher am Organoidmodell studieren.
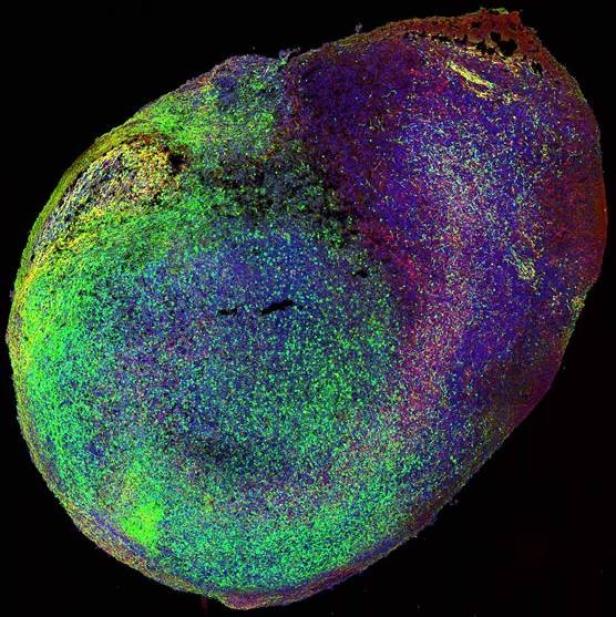
Ein aus zwei Teilen "zusammengeklebtes" Organoid.
© IMBA
Krankes Gewebe
Neben Epilepsie werden in Wien auch die zellulären Grundlagen anderer Krankheiten erforscht, etwa von Autismus oder Mikrozephalie. In manchen Fällen könnten die Organoidmodelle sogar Wege zu möglichen Therapien aufzeigen. „Ich bin immer darauf angewiesen, dass die Krankheiten genetisch bedingt sind. Umwelteinflüsse kann ich am Organoid nicht modellieren. Autismus ist zwar eine Verhaltenskrankheit, aber es gibt Erbkrankheiten, die sie auslösen. Da kann ich Stammzellen nehmen, das modellieren und schauen, was in dem Gehirnorganoiden anders ist. Welche Ionenkanäle sind beteiligt zum Beispiel. Es gibt entsprechende Medikamente, die dort angreifen“, erklärt Knoblich.
In Zukunft könnten die Organoide auch gezielt für die Entwicklung von Medikamenten herangezogen werden. „In naher Zukunft sollte es hoffentlich möglich sein, Organoide im Hochdurchsatz zum Testen von Medikamenten zu verwenden. Das muss man sich so vorstellen, dass man 100.000 Organoide herstellt und dann 100.000 Medikamente hinzu gibt, um zu sehen, wie Zellen von einem gesunden Probanden und Epilepsiepatienten darauf ansprechen. Uns interessieren die Chemikalien, die ein ,Epilepsie-Organoid’ einem ,gesunden Gehirn-Organoid’ ähnlich machen“, sagt der Biochemiker.
Neben möglichen therapeutischen Anwendungen könnten die Organoide auch helfen, unser Verständnis des menschlichen Gehirns zu erweitern. Hier gibt es allerdings Limitationen. Denn obwohl die zerebralen Organoide mittlerweile komplexer geworden sind, sind sie mit einem vollständigen menschlichen Gehirn nicht zu vergleichen. „Die Funktionsweise von Nervenzellen oder ihr Zusammenspiel kann man im Organoid untersuchen. Aber verstehen, wie ein Gedanke funktioniert, das geht nicht. Die Funktionsweise eines menschlichen Gehirns wird man nur integrativ über theoretisches und mathematisches Modellieren verstehen“, sagt Knoblich.
Fliegenhirn
Obwohl ein Organoid aus bis zu 50 Millionen Nervenzellen bestehen kann und die Zellen untereinander Signale austauschen können, ist er von einem Gehirn weit entfernt. Neben der Struktur fehlen dem Organoid auch ein Immunsystem und Blutgefäße. Er wird von außen über die Nährlösung mit Sauerstoff und anderen essenziellen Bausteinen versorgt. „Das Gehirn einer Fruchtfliege ist viel geordneter und komplexer. Der Organoid ist zufällig verschaltet und entspricht eher dem Gewebe, das bei einer Hirntumoroperation entfernt wird“, sagt Knoblich.
Deshalb macht sich der IMBA-Direktor auch keine Sorgen, dass jemand die Organoid-Technologie missbrauchen könnte, um ein echtes Gehirn im Glas zu züchten: „Es ist völlig undenkbar, dass wir mit dieser Methode Organoide herstellen, in denen sich auch nur im Entferntesten etwas entwickelt, das einem menschlichen Gehirn ähnelt.“ Das heißt aber nicht, dass ethische Fragen nicht abgewägt werden. „Für mich reicht schon die Tatsache aus, dass es um mich herum Leute gibt, die sich Sorgen machen, um ethische Fragen zu berücksichtigen“, sagt Knoblich.

Organoid in der Aufzuchtschale
© IMBA
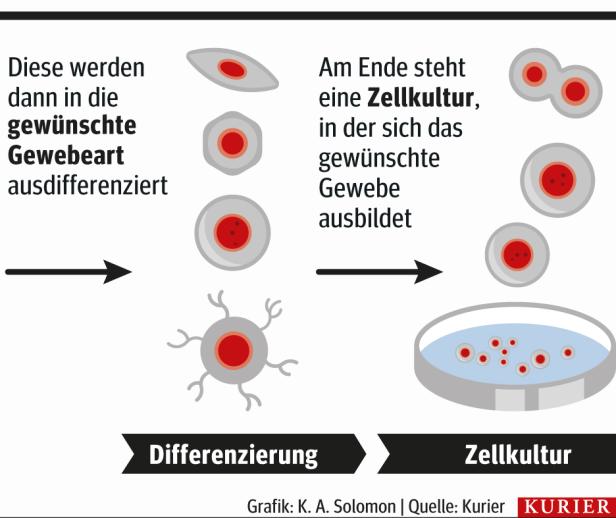
So entsteht ein zerebrales Organoid
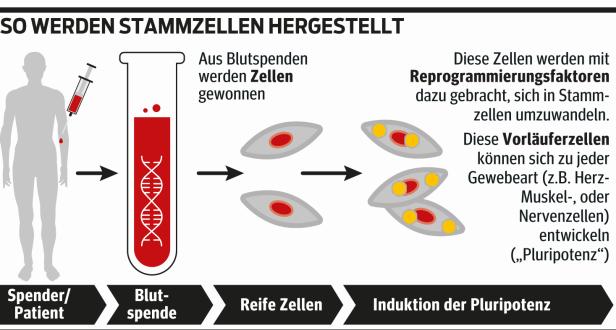
Die Entwicklung eine zerebralen Organoiden beginnt mit einer Blutspende, die im Falle des IMBA aus einer Biobank oder im Rahmen einer Kooperation mit dem AKH von Patienten mit bestimmten Erkrankungen kommt. Daraus werden sogenannte periphere Blutstammzellen isoliert, in die man mit Hilfe eines Virus vier Gene einschleust, die die Verwandlung in sogenannte Induzierte pluripotente Stammzellen (IPS) auslöst. Diese Reprogrammierung dauert etwa einen Monat. Für diesen Zelltyp gibt es keine Entsprechung in Embryonen, sie sind ein Kunstprodukt.
Die IPS werden dann in einer Kulturschale gehalten, wo sie unter dem Einfluss der passenden Wachstumsfaktoren beginnen, sich in die gewünschte Gewebeart auszudifferenzieren. Im Falle der zerebralen Organoide wird die Nährlösung so angepasst, dass sich Nervenzellen bilden. Die Zellhaufen werden dann auf ein Gerüst aus Protein-Gel aufgebracht. Damit sich dreidimensionale Strukturen ausbilden, werden die Geltropfen durch mechanische Bewegung stets in Schwebe gehalten. So entsteht ein Organoid, der bis zu einem Jahr lang überleben kann.
Zur Person: Jürgen Knoblich
Der wissenschaftliche Direktor des Instituts für Molekulare Biotechnologie (IMBA) der Österreichischen Akadamie der Wissenschaften (ÖAW) in Wien ist studierter Biochemiker. Sein Studium absolvierte der Bayer in Deutschland und England. Danach folgte ein Forschungsaufenthalt in San Francisco. Seit 2005 ist er am Institut für Molekulare Biotechnologie in Wien tätig. Daneben lehrt er auch an der Universität Wien. Sein Forschungsschwerpunkt sind neuronale Stammzellen. Seine Forschungsgruppe hat maßgeblich zum Verständnis der asymmetrischen Zellteilung bei Stammzellen beigetragen.
Kommentare