
Wiener Software zählt Krebszellen im Blut von Kindern
Dieser Artikel ist älter als ein Jahr!
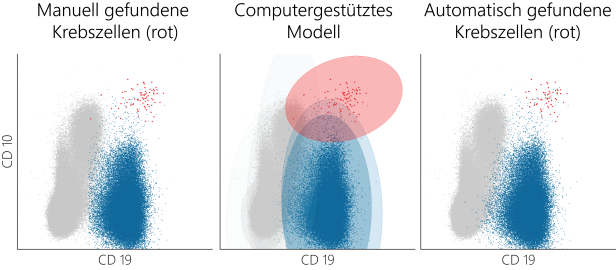
Je nach Anzahl der Krebszellen im Blut lässt sich die Intensität einer Krebserkrankung wie Leukämie feststellen. Um die zu ermitteln, kommt in klinischen Zentren die sogenannte Durchflusszytometrie zur Anwendung. Ein Durchflusszytometer liefert Daten mit Messungen von physikalischen und molekularen Eigenschaften einzelner Zellen in einer Knochenmarks- oder Blutprobe, erklärt Michael Reiter, Forscher am Computer Vision Lab der TU Wien und Informatiker bei der St. Anna Krebsforschung: „Dabei werden in wenigen Minuten Hunderttausend bis Millionen von Zellen hintereinander, einzeln vermessen. Ein Datensatz einer Probe besteht also aus Messungen von sehr vielen Zellen.“
Jede Zelle werde durch zehn bis 20 oder mehr quantitative Merkmale beschrieben, anhand derer die oft wenigen Krebszellen in der Probe identifiziert werden können.
Leukämie bei Kindern
Die Analyse ist aufwendig und braucht ein geschultes Auge. „Wie schnell eine Laborexpertin oder ein -experte die Krebszellen unter den vielen anderen Zellen findet, hängt stark von der persönlichen Erfahrung ab und davon, wie diese Krebszellen ausschauen“, sagt der Forscher der futurezone. Manche seien aufgrund ihres klassischen Aussehens einfacher zu finden, andere wegen ihrer speziellen, selteneren Optik schwieriger.
Eine Erleichterung bringt eine Software, die vom Team rund um Reiter gemeinsam mit der St. Anna Krebsforschung im Rahmen des von der Österreichischen Forschungsförderungsgesellschaft FFG geförderten Projekts „FlowMe“ entwickelt wurde. Sie basiert auf einem neuronalen Netzwerk und macht Krebszellen in der Durchflusszytometrie automatisch ausfindig.

Der Durchflusszytometer durchleuchtet per Laser Bluttröpfchen
© TU Wien/ Florian Kleber
„Welche Merkmale man messen will, hängt von der Krebsform ab – in unserem Fall sind das Leukämien bei Kindern“, sagt Reiter. Konkret wird das System auf die akute lymphatische Leukämie (ALL) – die häufigste Form von Leukämie im Kindesalter – sowie auf die akute myeloische Leukämie (AML) angepasst.
Muster in Daten
Das neuronale Netzwerk kann die Datensätze aus der Durchflusszytometrie verarbeiten und in den Daten Muster wie Häufungen von Zellen mit ähnlichen Merkmalsausprägungen wiedererkennen und zur Bestimmung von Krebszellen nutzen. „Das Modell wird mit Hunderten von Datensätzen trainiert, wobei wir beim Training dem Modell auch mitteilen, wo die Krebszellen im Datenraum sind. Diese Information haben wir, weil wir Datensätze verwenden, die vom Fachpersonal im medizinischen Labor in der klinischen Routine bereits manuell bewertet wurden.“
Die Daten stammen von verschiedenen klinischen Zentren weltweit. „In den Daten steckt also viel verborgenes Wissen, Intuition und Erfahrung der Laborexpert*innen, ein implizites Wissen, das sich durch maschinelles Lernen in Algorithmen verpacken lässt,“ sagt Reiter. Während eine geübte Fachperson bei der ALL im Schnitt 10 Minuten für die Bewertung einer Probe benötige, brauche die Software nur einen Bruchteil einer Sekunde. Sie könnte dann etwa das Ergebnis liefern, dass zu einem bestimmten Zeitpunkt der Therapie nur noch sehr wenige Krebszellen vorhanden sind.
© Ian Ehm
„Wenn das im konkreten Beispiel der ALL unter 0,1 Prozent der Zellen sind, die sonst noch im Knochenmark vorkommen, kann man sagen, dass dieses Kind sehr gut auf die Therapie anspricht und in Folge keine so starke Chemotherapie mehr braucht, wie vielleicht ein anderes Kind, das zu diesem Zeitpunkt noch viele Krebszellen im Knochenmark hat.“ Auf diese Weise ließe sich die Therapie maßgeschneidert für jedes Kind anpassen.
Qualitätskontrolle
Die letzte Entscheidung trifft zwar der Mensch, eine unerwartete Vorhersage der Software könne aber etwa dazu führen, dass man bei einem oder einer Patient*in noch genauer hinsieht. So könne das System zur Qualitätskontrolle eingesetzt werden. Zudem könne es als virtueller Trainingspartner für noch wenig geübtes Personal dienen.
Aktuell beschäftigt sich das Forschungsteam damit, wie gut es mit FlowMe an die manuelle Bestimmung von Krebszellen durch das Fachpersonal im Labor herankommt. „Wir bewegen uns bei der ALL bereits innerhalb der Abweichungen, die es auch zwischen verschiedenen Fachpersonen gibt, wenn sie denselben Datensatz beurteilen.“ Für die ALL werde die Software gerade für den Einsatz in einem Netzwerk klinischer Zentren vorbereitet, die mit der St. Anna Kinderkrebsforschung und dem St. Anna Kinderspital verbunden sind.

© Getty Images/FatCamera/IStockphoto.com
Künftig könnten Algorithmen genauere Ergebnisse liefern, als das Fachpersonal – „vor allem, wenn die Muster in den Daten aufgrund der steigenden Leistungsfähigkeit der Durchflusszytometer komplexer werden,“ sagt Reiter. Wird das Modell mit entsprechenden Daten trainiert, könne es außerdem auch mit anderen Blutkrebsformen umgehen.
Diese Serie erscheint in redaktioneller Unabhängigkeit mit finanzieller Unterstützung der Forschungsförderungsgesellschaft (FFG).
System hilft tödliche Verläufe akuter myeloischer Leukämie zu vermeiden
Eine akute myeloische Leukämie (AML) ist eine Form von Blutkrebs, die äußerst schwer diagnostizierbar ist. Wird eine Diagnose früh gestellt, stehen die Heilungschancen aber gut. Besteht der Verdacht auf AML, kann ein Knochenmarkausstrich für Klarheit sorgen.
Dabei werden die Blutkörperchen im Knochenmark analysiert. Sind die Vorläuferzellen der weißen Blutkörperchen – die sogenannten „Blasten“ – defekt, werden in Folge fehlerhafte Blutkörperchen erzeugt, die ihren Aufgaben nicht nachkommen können.
Um das zu erkennen, braucht ein*e Mediziner*in viel Erfahrung, denn die Auswertung der Bilddaten ist hochkomplex. Eine künstliche Intelligenz (KI), die in Kooperation der Technischen Universität Dresden und der Uniklinik Dresden entwickelt wurde, soll Mediziner*innen unterstützen, die Erkrankung frühzeitig zu erkennen und tödliche Verläufe zu vermeiden.
Zelltypen-Unterschied
Für die Entwicklung wurden Bilddaten von Knochenmarkausstrichen von 1.250 AML-Patient*innen und 230 gesunden Knochenmarkspender*innen analysiert. Als Basis für den maschinellen Lernprozess dienen 90.000 Einzelzellen. Im Laufe ihres Trainings lernt die Software die unterschiedlichen Zelltypen und Zelleigenschaften zu unterscheiden.
Der jeweilige Bildbereich aus den Knochenmarkausstichen wird digitalisiert und auf das System übertragen. Die Kategorisierung von Zellen geht dann automatisch vonstatten. Das System unterscheidet den Knochenmarkausstrich eines/r AML-Patient*in mit über 95 Prozent Genauigkeit von jenem eines gesunden Menschen. An äußeren Zellmerkmalen könne es den Forscher*innen zufolge außerdem bestimmte genetische Veränderungen mit einer Präzision von 85 Prozent erkennen.
Die künstliche Intelligenz übernimmt die Aufgabe von Mediziner*innen nicht, sondern ergänzt ihre Analyse um einen datenbasierten, objektiven Befund.



Kommentare